



📰خوردگی یک واکنش شیمیایی و یا الکتروشیمیایی مخرب بین سطح فلز و محیط اطراف آن است. با توجه به اینکه از لحاظ ترمودینامیکی مواد اکسید شده نسبت به مواد در حالت معمولی در سطح پایین تری از انرژی قرار دارند، بنابراین تمایل رسیدن به سطح انرژی پایین تر سبب اکسید (خورده) شدن فلز میگردد. با این توضیح میتوان گفت که هیچگاه نمیتوان به طور کامل از خوردگی جلوگیری نمود، بلکه باید به نحوی میزان خوردگی را به حد قابل قبول رسانید.
خوردگی سبب به وجود آمدن زیان های فراوانی در کارایی سیستم های مختلف میگردد. علاوه بر خسارت های جانی از نظر اقتصادی نیز خسارت های فراوانی ایجاد مینماید. به طور کلی برای بررسی یک آلیاژ از نظر مقاومت در برابر خوردگی باید پارامترهای گوناگونی را مورد بررسی قرار داد، اما شاید متداول ترین راه برای بررسی مسائل خوردگی و همچنین مقایسه فلزات مختلف با یکدیگر، بیان نمودن سرعت و یا نرخ انجام واکنش خوردگی باشد. برای انجام این کار راهها و مقیاس های متفاوتی وجود دارد.
برای بیان سرعت خوردگی میتوان درصد کاهش وزن را بر حسب میلیگرم بر سانتیمتر مربع بر روز (mdd) بیان نمود. البته این معیار چندان مناسب نیست، زیرا در اکثر موارد محصولات حاصل از واکنش خوردگی (اکسید و یا هیدروکسید فلز) بر روی سطح فلز میمانند و در حقیقت سبب افزایش وزن فلز بعد از انجام واکنش خوردگی میگردند. بنابراین معمولاً به دلیل اهمیت بیشتر ضخامت قطعه، از معیار هزارم اینچ در سال(mpy) استفاده میگردد، یعنی در طول یک سال چه میزان از ضخامت جسم کاسته میشود.
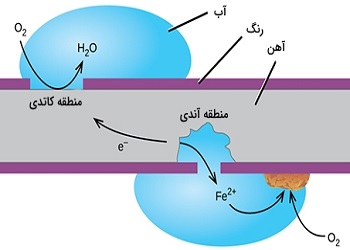
خوردگی را میتوان از نظر الکتروشیمیایی نیز مورد بررسی قرار داد. به طور کلی هر واکنشی را که بتوان به دو واکنش جداگانه آندی و کاتدی قسمت نمود، واکنش الکتروشیمیایی مینامند.
برای انجام واکنش خوردگی سه عامل آند (قسمتی که الکترون تولید مینماید و یا به عبارت دیگر اکسید میگردد)، کاتد (قسمتی از فلز که الکترون میگیرد و یا واکنش احیا در آن صورت میگیرد) و در نهایت الکترولیت (مکانی برای برقراری اتصال یونی بین آند و کاتد) لازم است. در حقیقت باید بین آند و کاتد هم اتصال الکتریکی (برای مبادله الکترون) و هم اتصال الکترولیتی (برای مبادله یون) برقرار باشد. با از بین بردن هر کدام از این اتصالات واکنش خوردگی نیز متوقف میگردد.
به عنوان مثال در واکنش خورده شدن روی در محیط اسیدکلریدریک محصول نهایی واکنش کلرور روی و گاز هیدروژن است که از طریق واکنش زیر انجام میگردد:
Zn + 2 HCl →ZnCl2 + H2
به طور خلاصه میتوان واکنش های اکسیداسیون و احیا را برای این واکنش به صورت زیر بیان نمود:
Zn → Zn+2 + 2e-
2H+ + 2e- → H2
نکته مهم در واکنش های اکسیداسیون و احیا سرعت انجام واکنش ها است. طبق اصول سینتیکی باید سرعت انجام واکنش اکسیداسیون با سرعت انجام واکنش احیا برابر باشد. بنابراین با تحت کنترل قرار دادن هریک از این دو واکنش میتوان سرعت انجام واکنش دیگر و در نتیجه سرعت انجام واکنش خوردگی را تحت کنترل درآورد.
از طرف دیگر اگر در سیستم خوردگی به جای یک عامل احیا چندین عامل احیا وجود داشته باشد، به عنوان مثال در همان اسید کلریدریک اگر اکسیژن نیز وجود داشته باشد، آنگاه دو واکنش احیا هیدروژن و واکنش احیا آب همزمان انجام خواهند شد. به این ترتیب به دلیل افزایش در میزان مصرف کننده های الکترون، باید بر میزان سرعت تولید الکترون نیز افزوده گردد و به این دلیل سرعت خوردگی فلز روی افزایش خواهد یافت.
علاوه بر فاکتورهای محیطی و محیط خورنده، بعضی فاکتورهای فلزی و متالورژیکی نیز در آغاز و نرخ پیشرفت واکنش های خوردگی تاثیرگذار میباشند. به عنوان مثال مرزهای دانه، مرزهای دوقلویی، ناخالصی ها و نابجائیها میتوانند به دلیل داشتن انرژی بالاتر نسبت به نقاط اطراف خود به صورت آند موضعی درآمده و سبب آغاز فرایند خوردگی گردند.
🗂منبع: انجمن خوردگی ایران
📋گردآوری: واحد تهیه محتوای اصفهان پوشش
09138271941☎️
بستن *نام و نام خانوادگی * پست الکترونیک * متن پیام |
